A un reactor químico entan 24 lb de carbono y 300 lb de aire. En el reactor tiene lugar la combustión del carbono según el proceso: $C+O_{2}\rightarrow CO_{2}$. Calcula las libras y moles que salen del reactor.
Dibujamos el diagrama de flujo:
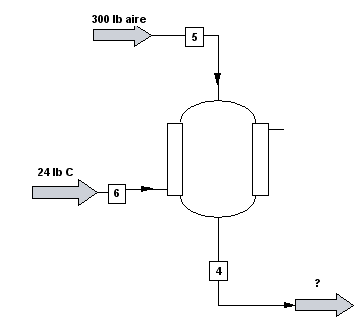
Calculamos las lb-mol de carbono, oxígeno y nitrógeno en la entrada:
Carbono: \begin{equation} 24\ lb\ C\frac{1\ lb-mol\ C}{12\ lb\ C}=12\ lb-mol\ C \end{equation} Oxígeno: \begin{equation} 300\ lb\ aire\frac{21\ lb\ O_{2}}{100\ lb\ aire}\frac{1\ lb-mol\ O_{2}}{32\ lb\ O_{2}}=2,18\ lb-molO_{2} \end{equation} Nitrógeno: \begin{equation} 300\ lb\ aire\frac{79\ lb\ N_{2}}{100\ lb\ aire}\frac{1\ lb-mol\ N_{2}}{28\ lb\ N_{2}}=8,20\ lb-mol\ N_{2} \end{equation} Teniendo en cuenta la estequiometría de la reacción y el rectivo limitante (carbono), se calculan las lb-mol de los gases a la salida del reactor.
Dióxido de carbono: 2 lb-mol.
Las lb-mol de dióxido de carbono formadas son iguales a las consumidas de carbono.
Oxígeno: $2,18 - 2 = 0,18\ lb-mol\ de\ O_{2}$.
2 lb-mol de oxígeno reaccionan con el carbono, por tanto, salen 0,18 lb-mol de oxígeno.
Nitrógeno: 8,20 lb-mol.
El nitrógeno es inerte, por tanto, sale la misma cantidad que entra.


