En una planta se producen 800 t/día de amoniaco a partir de una mezcla estequiométrica de nitrógeno/hidrógeno, que contiene 0.15 moles de argon por cada 100 moles de mezcla $N_2/H_2$. En el reactor se alcanza una conversión del 25$\%$. El amoniaco producido condensa y los gases que no han reaccionado se recirculan al reactor. La concentración de argon a la entrada de éste, una vez mezcladas las corrientes de recirculación y de alimentación fresca, no debe ser superior a 3.5 moles/100 moles de mezcla $N_2/H_2$. Calcular:
a) Flujo molar de alimentación fresca
b) Flujo molar de la corriente de recirculación a la salida del condensador.
c) Flujo molar de la corriente de purga.
a) $9.69x10^{7}\;moles/día$; b) $2.67x10^8\;moles/día$; c) $2.46x10^6\; moles/día$
Respuesta:
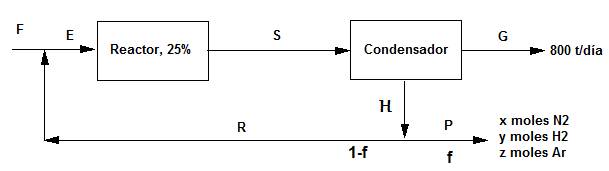
Base de cálculo: 100 moles de $N_2/H_2$ en F.
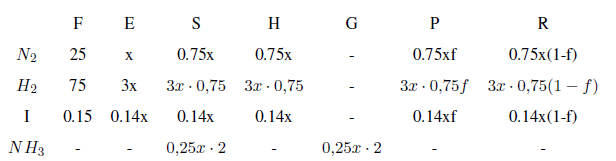
En la corriente A tenemos 3.5 moles de Ar por cada 100 moles de mezcla nitrógeno/hidrógeno. La fracción molar de Ar en esta corriente es: $3.5/103.5=0.0338$. Dicha fracción molar se puede igualar a $\frac{I}{4x+I}=0.0338$. Despejando los moles de inerte: $I=0.14x$
Balance local (punto de mezcla), parcial al nitrógeno:
$25+0.75x(1-f)=x$
Balance a los inertes en el punto de mezcla:
$0.15+0.14x(1-f)=0.14x$
Resolviendo el sistema: x= 97.57 y f=0.008
Amoniaco producido con la base de cálculo tomada: 0.5x=48.78 moles.
Transformamos en moles los 800 kg de amoniaco que se desean producir: $4.7x10^7$ moles.
Factor de escala: $\frac{4.7x10^7}{48.78}= 6.65x10^5\;dia^{-1}$
Multiplicando los datos de la tabla por el factor de escala se obtienen los flujos molares reales que circulan por el sistema.
Por ejemplo, $F=100.15\; mol x 9.65x10^5\;dia^{-1}= 9.69x10^7$ mol/día.


