Se ha despertado un interés considerable en la conversión de carbón en productos líquidos más útiles para la subsecuente producción de compuestos químicos. Dos de los principales gases que podemos generar en condiciones apropiadas a partir de la combustión de carbón in situ en presencia de vapor de agua (como sucede en presencia de aguas freáticas) son $H_2$ y CO. Después de lavarlos, estos dos gases se pueden combinar para producir metanol de acuerdo con la siguiente ecuación: $CO+2H_2\rightarrow CH_3OH$. Se usa un flujo de purgado para mantener la concentración de $CH_4$ en la salida del separador en no más de 3.2$\%$ mol. La conversión por paso de CO es del 18$\%$. Todas las composiciones están en fracciones molares o porcentajes molares. Los flujos están en moles. Calcular:
a) Los moles de reciclaje
b) Los moles de metanol producido
c) La cantidad purgada por mol de alimentación
d) La composición del gas de purga.
Solución:
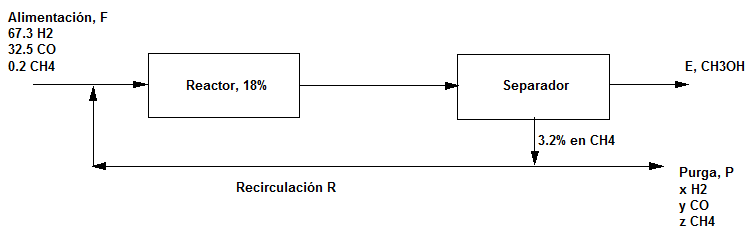
Base de cálculo 100: moles de alimentación.
Balance global parcial al H: $135.5=4E+2x+4z$
Balance global parcial al C: $32.5=y+z+E$
Balance global parcial al O: $32.5=E+y$
La corriente de purga contiene un 3.2$\%$ de $CH_4$, $z=0.032P$, es decir, $z=0.032(x+y+z)$.
Este sistema de cuatro ecuaciones nos permite calcular las cuatro incognitas, x,y,z,E.
x=4.8 moles; y=1.25 moles; z=0.2 moles; E=31.25 moles. La corriente de purga P=6.25 moles.
6.25 moles purgados/100 moles alimentados = 0.0625
Composición de la corriente de purga: $H_2$:76.8$\%$; CO: 20$\%$; $CH_4$:3.2$\%$.

Para obtener flujo molar recirculado hacemos un balance local (al punto de purga) y parcial (CO):
$(32.5+0.2R)(0.82)=0.2R+1.25$
R=705 moles


