A la cámara de combustión de una caldera se alimenta una mezcla gaseosa formada por propano y oxígeno, con un 80$\%$ del primero, que se quema con un 200 % de exceso de aire. Sabiendo que un 80 % del propano se transforma en CO2, un 10 % en CO y el resto permanece sin quemarse, calcular la composición del gas de combustión.
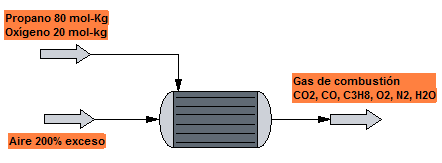
Reacciones que tienen lugar:
$C_3H_8 + 5O_2\rightarrow 3CO_2 + 4H_2O$
$C_3H_8+7/2O_2\rightarrow 3CO + 4H_2O$
Entrada:
Base de cálculo 100 mol-kg de alimentación.
Oxígeno teórico: 400 mol-kg
Oxígeno requerido: 380 mol-kg
Oxígeno que entra: requerido x 3 = 1140 mol-kg
Nitrógeno que entra: 4289 mol-kg.
Oxígeno consumido: 348 mol-kg
Salida:
$CO_2$: 192 mol-kg
CO: 24 mol-kg
$C_3H_8$: 8 mol-kg
Oxígeno: 812 mol-kg
Nitrógeno: 4289 mol-kg
Agua: 288 mol-kg.
Moles totales a la salida: 5613 mol-kg
Composición del gas de combustión: 0.14$\% C_3H_8$; 14.47$\% O_2$; 76.41$\% N_2$; 3.42$\% CO_2$; 0.43$\% CO$; 5.13$\% H_2O$


