- Detalles
- Escrito por: Germán Fernández
- Categoría: Balances de materia a procesos de combustión
- Visto: 1097
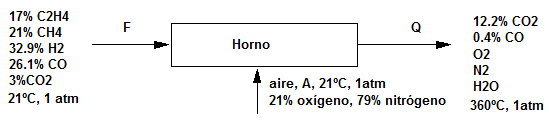
Es conveniente conocer las siguientes definiciones:
- Gas de combustión: Todos los gases que resultan de un proceso de combustión, incluido el vapor de agua. (base húmeda)
- Análisis Orset: todos los gases que resultan de un proceso de combustión sin incluir el vapor de agua.
- Aire teórico: cantidad de aire u oxígeno requerido para lograr la combustión completa. También se conoce como aire u oxígeno requerido.
- Aire en exceso: cantidad de aire u oxígeno en exceso con respecto al requerido para una combustión completa. \begin{equation} \%aire\ en\ exceso\ =\frac{aire\ en\ exceso}{aire\ requerido}\cdot100 \end{equation} También puede definirse como: \begin{equation} \%aire\ en\ exceso\ =\frac{O_{2}\ que\ entra\ en\ el\ proceso\ - O_{2}\ requerido}{O_{2}\ requerido}\cdot100 \end{equation}
- Detalles
- Escrito por: Germán Fernández
- Categoría: Balances de materia a procesos de combustión
- Visto: 949
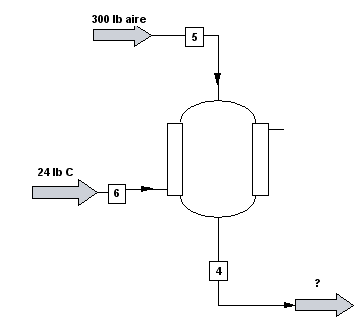
A un reactor químico entan 24 lb de carbono y 300 lb de aire. En el reactor tiene lugar la combustión del carbono según el proceso: $C+O_{2}\rightarrow CO_{2}$. Calcula las libras y moles que salen del reactor.
Dibujamos el diagrama de flujo:
Lee más: Balance de materia, combustión de dióxido de carbono
- Detalles
- Escrito por: Germán Fernández
- Categoría: Balances de materia a procesos de combustión
- Visto: 803
A la cámara de combustión de una caldera se alimenta una mezcla gaseosa formada por propano y oxígeno, con un 80$\%$ del primero, que se quema con un 200 % de exceso de aire. Sabiendo que un 80 % del propano se transforma en CO2, un 10 % en CO y el resto permanece sin quemarse, calcular la composición del gas de combustión.
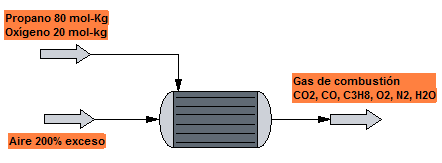
Reacciones que tienen lugar:
$C_3H_8 + 5O_2\rightarrow 3CO_2 + 4H_2O$
$C_3H_8+7/2O_2\rightarrow 3CO + 4H_2O$
Entrada:
Base de cálculo 100 mol-kg de alimentación.
Oxígeno teórico: 400 mol-kg
Oxígeno requerido: 380 mol-kg
Oxígeno que entra: requerido x 3 = 1140 mol-kg
Nitrógeno que entra: 4289 mol-kg.
Oxígeno consumido: 348 mol-kg
Salida:
$CO_2$: 192 mol-kg
CO: 24 mol-kg
$C_3H_8$: 8 mol-kg
Oxígeno: 812 mol-kg
Nitrógeno: 4289 mol-kg
Agua: 288 mol-kg.
Moles totales a la salida: 5613 mol-kg
Composición del gas de combustión: 0.14$\% C_3H_8$; 14.47$\% O_2$; 76.41$\% N_2$; 3.42$\% CO_2$; 0.43$\% CO$; 5.13$\% H_2O$
- Detalles
- Escrito por: Germán Fernández
- Categoría: Balances de materia a procesos de combustión
- Visto: 991
Inicialmente se mezcla etano con oxígeno para obtener un gas de 80$\%$ de $C_2H_6$ y 20$\%$ de $O_2$ que después se quema con un 200$\%$ de exceso de aire. El 80$\%$ del etano pasa a $CO_2$, 10$\%$ pasa a CO y 10$\%$ permanece sin quemarse. Calcular la composición del gas de escape (combustión) sobre una base húmeda.
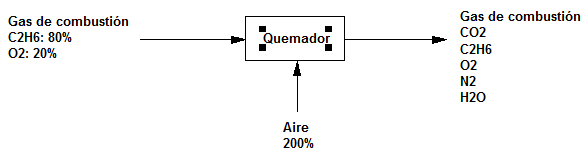
Base de cálculo 100 mol-kg de gas de combustión.
$C_2H_6 + 7/2O_2 \rightarrow 2CO_2 +2H_2O$
$C_2H_6+5/2O_2\rightarrow 2CO + 3H_2O$
- Entrada:
- Cálculo del oxígeno teórico, oxígeno requerido para la combustión completa: 280 mol-kg
- Oxígeno requerido (aire): 280-20=260
- Oxígeno que entra por el aire (200$\%$ en exceso): 780 mol-kg
- Nitrógeno que entra: 2930 mol-kg.
- Oxígeno consumido: 224+20=244 mol-kg.
- Salida:
- Dióxido de carbono:128 mol-kg.
- Monóxido de carbono: 16 mol-kg.
- Agua: 192+24=216 mol-kg.
- Oxígeno: 780+20-244=556 mol-kg
- Nitrógeno: 2930 mol-kg.
- $C_2H_6$: 8 mol-kg
- Detalles
- Escrito por: Germán Fernández
- Categoría: Balances de materia a procesos de combustión
- Visto: 932